


1. 试验药物简介
TASELISIB是PIK3CA的选择性抑制剂。
本试验的适应症是ER阳性/HER2阴性的局部晚期或转移性乳腺癌。
2. 试验目的
评价雌激素受体阳性和HER2阴性、局部晚期或转移性乳腺癌以及接受芳香化酶抑制剂治疗时或治疗后疾病复发或疾病进展的绝经后女性的疗效、安全性、药理学和患者自报结果(PRO)。
3. 试验设计
试验分类:安全性和有效性
试验分期: III期
设计类型:平行分组
(试验组:TASELISIB+氟维司群,对照组:氟维司群)
随机化: 随机化
盲法: 双盲
试验范围:国际多中心试验
入组人数:总体600人,中国40人
4. 入选标准
1 能够并愿意提供书面知情同意书并依从研究方案。
2 年龄≥ 18岁。
3 ECOG体能状态为0或1。
4 绝经后状态为以下任何一种: 年龄≥ 60岁或年龄< 60岁,根据记录的卵泡刺激素和雌二醇水平在绝经后范围内,且在没有接受化疗、他莫昔芬、托瑞米芬或卵巢抑制治疗的情况下停经12个月来定义绝经既往双侧卵巢切除术(在第1周期,第1天接受首次氟维司群治疗前至少28天)。
5 同意提供一个福尔马林固定的石蜡包埋(FFPE)的组织块(最好),或提供来自于最近取得且可获得的肿瘤组织的最少20张(最好为25张)新切的未染色肿瘤组织切片,用于PIK3CA突变检测和其它方案规定要进行的探索性检测。
6 所有患者均需有由中心实验室的cobas方法检测出有效的PIK3CA基因突变的结果(比如,PIK3CA基因突变结果为“无效”或“失败”的患者不能入选研究)在120名PIK3CA状态为“野生型”(未检测到突变)的乳腺癌患者入组完成后, 所有剩余的入选患者,必须有一个PIK3CA基因突变呈阳性的乳腺癌标本才可入选研究。
7 足够的血液学和终末器官功能,由以下在第1周期,第1天前28天内的实验室检查结果定义: ANC ≥ 1500 μL(1.5×109/L),血小板计数≥ 100,000 μL(100×109/L),血红蛋白≥ 9.0 g/dL(90 g/L),总胆红素≤1.5倍正常上限(ULN),但是既往患有吉尔伯特综合征的患者,其总胆红素≤3 mg/dL,天冬氨酸氨基转移酶和丙氨酸氨基转移酶≤ 1.5倍正常上限,以下情况除外: 证实患肝转移的患者:天冬氨酸氨基转移酶和/或丙氨酸氨基转移酶≤5.0倍正常上限,血清肌酐≤1.5倍正常上限或根据Cockroft-Gault肾小球滤过公式估算的肌酐清除率≥ 50 mL/min,INR < 1.5和aPTT(或PTT)< 1.5倍正常上限;对需要抗凝治疗的患者,稳定INR≤2.5。
8 空腹血糖≤ 125 mg/dL(6.94mmol/L)。
5. 排除标准
1 当地实验室检查为HER2-阳性疾病(IHC 3+ 染色或原位杂交阳性)。
2 既往接受过氟维司群治疗。
3 既往接受过PI3K抑制剂、mTOR抑制剂(如依维莫司)或AKT抑制剂治疗。
4 在第1周期,第1天前的2周内接受既往抗癌治疗。
5 在第1周期,第1天前的2周内接受既往放射治疗。
6 所有急性的治疗相关的毒性必须消退为1级或1级以下或研究者认为稳定。
7 既往接受超过1次以上的针对MBC的细胞毒性化疗方案治疗。
8 症状性高钙血症,需要继续使用双膦酸盐或狄诺塞麦治疗,允许因其他原因使用双膦酸盐疗法或狄诺塞麦治疗(例如,骨转移、骨质疏松症等)。
9 同步激素替代疗法治疗。
10 已知的未经治疗的或活动性中枢神经系统转移(进展或需要抗惊厥药或糖皮质激素对症控制);如当地医疗监管部门的要求,在筛选期可进行脑部计算机断层扫描(CT) 或磁共振成像(MRI)。有中枢神经系统转移治疗史的患者,如果符合下列所有标准,则可入选:根据入选标准在中枢神经系统之外有可评价的或可测量的疾病,在完成中枢神经系统定向治疗后,影像学显示疾病改善,且在完成中枢神经系统定向治疗和研究影像学筛查之间没有中期进展的证据,无颅内出血或脊髓出血病史,完成放疗距第1周期,第1天之间的间隔最少为2周,并从严重(≥3级)急性毒性中恢复,且无持续的要求接受≥10 mg/天强的松或同等剂量的其他糖皮质激素药物治疗。
11 既往5年内有其他恶性肿瘤史,接受过适当治疗的原位宫颈癌、非黑色素瘤皮肤癌, I期子宫癌,或接受过可能无进展生存的疗法且没有疾病证据,并由治疗医师认为复发风险低的患者除外。
12 需要抗高血糖药物治疗的1型或2型糖尿病患者。
13 临床上重要的心脏或肺功能障碍,包括: 目前不受控制的≥ 2级高血压或不稳定型心绞痛,需要治疗的症状性充血性心力衰竭或严重心律失常,如患者有心房颤动和阵发性室上性心动过速或传导异常,但在治疗后,不会再有严重心律失常风险(例如,经过手术消融治疗的Wolff-Parkinson-White综合征)可入组。
14 目前静坐呼吸困难或任何需要吸氧治疗以进行日常活动的情况。
15 吸收不良综合征或其他会干扰肠内吸收的疾病史。
16 无力或不愿吞下药丸或接受肌肉注射。
17 临床显著肝病史,包括肝硬化、目前酒精滥用,或目前已知的HIV、乙型肝炎病毒 (HBV)或丙型肝炎病毒(HCV)活动性感染活动性感染定义为需要抗病毒治疗或乙型肝炎(乙肝表面抗原和/或总乙型肝炎核心抗体)或丙型肝炎病毒抗体检测结果为阳性。除非当地法规要求,如果以前未进行过,在筛选期不需要对患者进行HIV、HBV或HCV评价。乙肝核心抗体检测为阳性的患者,只有当乙肝表面抗体的检测结果也呈阳性,且 HBV DNA的聚合酶链反应(PCR)为阴性时才可入选研究。 HCV血清学呈阳性的患者,只有HCV RNA检测呈阴性才可入选研究。
18 炎症性肠病史(如,Crohn病和溃疡性结肠炎)。
19 活动性肠道炎症(如,憩室炎)。
20 由于当前活动性HIV感染导致免疫力低下状态,或因使用免疫抑制疗法治疗其他疾病而免疫力低下。
21 当前需要接受慢性皮质类固醇治疗(≥ 10 mg/日的强的松治疗或同等剂量的其他抗炎皮质类固醇治疗)。允许稳定使用(即第1周期,第1天前3个月内剂量没有变化)吸入糖皮质激素治疗。
22 妊娠、哺乳或母乳喂养。
23 当前患有重度、不受控制的全身性疾病(如,显著临床意义的心血管、肺或代谢性或感染性疾病)。
24 第1周期,第1天前28天内有重大外科手术或重大外伤,或研究治疗期间预期需要大手术治疗。
25 无法依从研究和随访程序。
26 无法理解当地语言版本的EORTCQLQ-C30,修订的乳腺癌模块QLQ-BR23和EQ-5D问卷。
6. 研究者信息
|
序号 |
机构名称 |
主要研究者 |
国家 |
省(州) |
城市 |
|
1 |
复旦大学附属肿瘤医院 |
胡夕春 |
中国 |
上海 |
上海 |
|
2 |
哈尔滨医科大学附属肿瘤医院 |
张清媛 |
中国 |
黑龙江 |
哈尔滨 |
|
3 |
吉林大学第一附属医院 |
李薇 |
中国 |
吉林 |
长春 |
|
4 |
河南省肿瘤医院 |
崔树德 |
中国 |
河南 |
郑州 |
|
5 |
辽宁省肿瘤医院 |
孙涛 |
中国 |
辽宁 |
沈阳 |
|
6 |
吉林省肿瘤医院 |
程颖 |
中国 |
吉林 |
长春 |
|
7 |
四川大学华西医院 |
郑鸿 |
中国 |
四川 |
成都 |
|
8 |
浙江省肿瘤医院 |
王晓稼 |
中国 |
浙江 |
杭州 |
|
9 |
云南省肿瘤医院 |
邹天宁 |
中国 |
云南 |
昆明 |
|
10 |
江苏省肿瘤医院 |
冯继锋 |
中国 |
江苏 |
南京 |
2. 备注【癌种】申请方舟援助计划


患者咨询电话:400-666-7998

全球肿瘤医生网提醒患者:国内细胞免疫治疗技术,包括cart细胞,树突细胞疫苗,NK细胞
TILs细胞,TCR t细胞治疗癌症疫苗等技术均处于临床试验阶段,未获准在医院正式使用。国内患者可以参加正规临床试验,在医生的监管下使用,全球肿瘤医生网不推荐患者贸然尝试任何医疗机构和研发机构的收费治疗。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。

-

-
肿瘤电场疗法——被FDA批准治疗复发性胶质母细胞瘤等
目前电场疗法已被FDA批准用于治疗复发性胶质母细胞瘤、新诊断的胶质母细胞瘤以及恶性胸膜间皮瘤,并且在目前在六大实体肿瘤包括非小细胞肺癌 详细»
-

-
临床试验中心——每一个新药都是一份希望
提供癌症临床试验招募信息、抗肿瘤新药受试者招募信息。 详细»
-

-
10个值得关注的乳腺癌临床试验招募项目
这一次,基因药物汇为大家汇总了招募乳腺癌患者的3大类、10小项临床试验项目,申请方法列在文末的海报上,希望能够帮助到正在寻求新药治疗的患者。 详细»
-
-
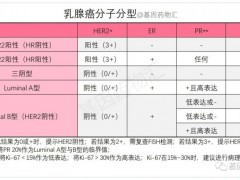
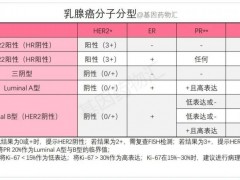
乳腺癌临床试验,乳腺癌不化疗的临床试验正在招募患者
从治疗的角度来说,乳腺癌的分子分型与治疗方案有非常密切的联系。 详细»
-

-
PARP抑制剂HTMC0435临床试验正在招募一线治疗失败的晚期乳腺癌患者
HTMC0435是一款PARP1/2抑制剂。根据目前的临床前研究结果,这款药物对于多类肿瘤、尤其是BRCA1/2突变的实体瘤有较好的治疗效果,最理想情况下可使肿瘤完全消退。 详细»
-

-
富龙康泰mTORC1/mTORC2双重抑制剂抑制剂FP-208临床试验正在招募经过治疗或无标准治疗方案的乳腺癌患者
FP-208是一款由北京富龙康泰研发的,基于新靶点、新机制的mTORC1/mTORC2双重抑制剂,拥有自主知识产权。 详细»
-
-
EGFR/HER2不可逆抑制剂AMX3009马来酸片临床试验正在招募HER2阳性的晚期乳腺癌患者
AMX-3009马来酸片是安润医药自主研发的一种EGFR/HER2不可逆抑制剂,其临床试验申请(化药1类)于2019年2月经国家药品监督管理局(NMPA)受理。 详细»
-

-
靶向联合免疫MRG002+HX008临床试验正在招募HER2低表达的晚期乳腺癌患者
这两款新药的组合,在HER2阳性以及HER2低表达的患者当中都具有一定的治疗潜力。 详细»
-
-
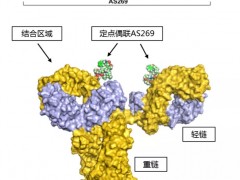
新码生物重组人源化抗HER2单抗-AS269偶联物(ARX788)HER2阳性乳腺癌临床试验II/III期招募整在进行中
ARX788是新码生物与Ambrx共同开发的一款靶向HER2阳性肿瘤抗体药物偶联物(ADC)。 详细»
-
-
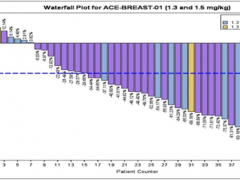
新码生物ARX788疗效数据媲美DS8201,HER2阳性乳腺癌临床试验招募进行中
新码生物ARX788疗效数据媲美DS8201,DCR高达100%! 详细»






























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城