


2. 备注【癌种】申请方舟援助计划


患者咨询电话:400-666-7998

全球肿瘤医生网提醒患者:国内细胞免疫治疗技术,包括cart细胞,树突细胞疫苗,NK细胞
TILs细胞,TCR t细胞治疗癌症疫苗等技术均处于临床试验阶段,未获准在医院正式使用。国内患者可以参加正规临床试验,在医生的监管下使用,全球肿瘤医生网不推荐患者贸然尝试任何医疗机构和研发机构的收费治疗。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。

-

-
肿瘤电场疗法——被FDA批准治疗复发性胶质母细胞瘤等
目前电场疗法已被FDA批准用于治疗复发性胶质母细胞瘤、新诊断的胶质母细胞瘤以及恶性胸膜间皮瘤,并且在目前在六大实体肿瘤包括非小细胞肺癌 详细»
-

-
临床试验中心——每一个新药都是一份希望
提供癌症临床试验招募信息、抗肿瘤新药受试者招募信息。 详细»
-

-
10个值得关注的乳腺癌临床试验招募项目
这一次,基因药物汇为大家汇总了招募乳腺癌患者的3大类、10小项临床试验项目,申请方法列在文末的海报上,希望能够帮助到正在寻求新药治疗的患者。 详细»
-
-
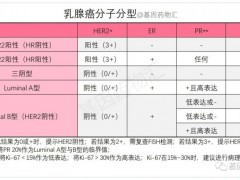
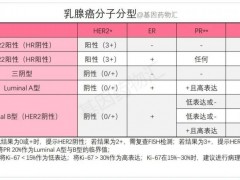
乳腺癌临床试验,乳腺癌不化疗的临床试验正在招募患者
从治疗的角度来说,乳腺癌的分子分型与治疗方案有非常密切的联系。 详细»
-

-
PARP抑制剂HTMC0435临床试验正在招募一线治疗失败的晚期乳腺癌患者
HTMC0435是一款PARP1/2抑制剂。根据目前的临床前研究结果,这款药物对于多类肿瘤、尤其是BRCA1/2突变的实体瘤有较好的治疗效果,最理想情况下可使肿瘤完全消退。 详细»
-

-
富龙康泰mTORC1/mTORC2双重抑制剂抑制剂FP-208临床试验正在招募经过治疗或无标准治疗方案的乳腺癌患者
FP-208是一款由北京富龙康泰研发的,基于新靶点、新机制的mTORC1/mTORC2双重抑制剂,拥有自主知识产权。 详细»
-
-
EGFR/HER2不可逆抑制剂AMX3009马来酸片临床试验正在招募HER2阳性的晚期乳腺癌患者
AMX-3009马来酸片是安润医药自主研发的一种EGFR/HER2不可逆抑制剂,其临床试验申请(化药1类)于2019年2月经国家药品监督管理局(NMPA)受理。 详细»
-

-
靶向联合免疫MRG002+HX008临床试验正在招募HER2低表达的晚期乳腺癌患者
这两款新药的组合,在HER2阳性以及HER2低表达的患者当中都具有一定的治疗潜力。 详细»
-
-
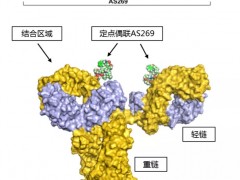
新码生物重组人源化抗HER2单抗-AS269偶联物(ARX788)HER2阳性乳腺癌临床试验II/III期招募整在进行中
ARX788是新码生物与Ambrx共同开发的一款靶向HER2阳性肿瘤抗体药物偶联物(ADC)。 详细»
-
-
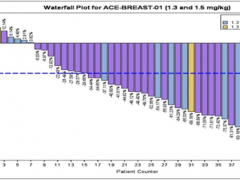
新码生物ARX788疗效数据媲美DS8201,HER2阳性乳腺癌临床试验招募进行中
新码生物ARX788疗效数据媲美DS8201,DCR高达100%! 详细»






























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城