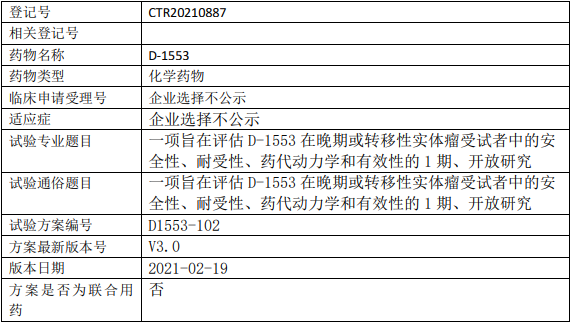
益方生物D-1553临床试验,评估D-1553在晚期或转移性实体瘤KRAS G12C突变受试者中的安全性、耐受性、药代动力学和有效性的1期、开放研究
1、试验目的
爬坡期:
1)评估 D-1553 在 KRASG12C 突变的晚期或转移性实体瘤受试者中的安全性和耐受性;
2)确定在 KRASG12C 突变的晚期或转移性实体瘤受试者中D-1553的剂量限制性毒性(DLT)、最大耐受剂量(MTD)和 2 期推荐剂量(RP2D);
扩展期:
1)进一步评估 D-1553 在 KRASG12C 突变的晚期或转移性非小细胞肺癌受试者中的安全性;
2)进一步评估 D-1553 在 KRASG12C 突变的晚期或转移性非小细胞肺癌受试者中的抗肿瘤活性;
3)进一步评估 D-1553 的 PK
2、试验设计
试验分类:安全性和有效性
试验分期:I 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.年龄 18 岁及以上的男性或女性受试者;
2.具有组织学证实的局部晚期、不可切除和/或转移性实体瘤的受试者;
3.受试者在肿瘤组织、血液、胸腔积液或其他含有癌细胞或DNA的样本中证实携带 KRASG12C 突变;
4.根据 RECIST v1.1 具有可测量病灶的受试者;
5.ECOG 体能状态评分为 0 或 1;
6.足够的肾功能,定义为采用修正的的 Cockroft-Gault 方程或其他机构标准公式计算,肌酐清除率≥60 mL/min,或肌酐≤1.5 x 正常范围上限(ULN);
7.有生育潜力的女性必须同意从签署 ICF 至参加研究的整个过程直至最后一次研究药物给药后 120 天内禁欲或采取有效的避孕方法;
8.男性受试者必须同意禁欲、或已进行绝育手术、或同意从签署ICF 至参加研究的整个过程直至最后一次研究药物给药后 120 天内使用有效的避孕方法;
排除标准
1.受试者在以下时间窗内曾接受过抗癌药或试验药物治疗:
a.既往任何时间曾接受针对 KRASG12C 突变的抑制剂,例如 AMG510、MRTX849、LY3499446 和 GDC-6036。 b. 在本研究首次给药前 14 天或 3 个半衰期内(以较短者为准)的任何抗癌疗法(包括化疗、靶向治疗、免疫治疗等)或任何其他试验性药物治疗。
2. 患有不稳定或进行性中枢神经系统(CNS)转移的受试者。
3. 患有急性心肌梗塞、严重/不稳定型心绞痛的受试者;或患有纽约心脏病协会的心功能分类 2 级或 2 级以上的心脏功能不全。
4. 受试者静息时的经 Fridericia 公式(QTcF)校正的 QT 间期延长,三次心电图(ECG)测量的平均 QTc 间期大于 480 ms。
5. 入组前 12 个月内患有中风或其他严重脑血管疾病的受试者。
6. 间质性肺疾病或任何活动性全身感染的受试者,包括但不限于严重的急性呼吸综合征冠状病毒 2(SARS-CoV-2)感染。
7. 研究者认为,受试者有药物滥用史,或存在可能会干扰研究的参与或干扰研究结果评估的医学、心理或社会状况。
8. 已知胃肠(GI)功能受损或患有可能会显著影响口服药物的吸收或代谢的 GI 疾病。
9. 既往抗癌治疗的毒性未消退,其定义为毒性(脱发除外)尚未消退至≤1 级(NCI CTCAE v5.0 版,对于周围神经疾病,≤2 级)。
10. 受试者在本研究给药前 4 周内进行了大手术,或在本研究给药前 2 周内接受了最后一次姑息性放疗。
11. 患有晶状体疾病的受试者。
12. 已知有人类免疫缺陷病毒(Human immunodeficiency virus,HIV)感染病史和/或获得性免疫缺陷综合症的受试者
13. 慢性乙型肝炎活动期或活动性丙型肝炎受试者。
14. 受试者当前正在接受或计划接受
a. 已知是 CYP3A4、CYP2B6、OATP1B1、OATP1B3 和 OAT1 底物的药物
b.已知是 CYP3A4的诱导剂或抑制剂的药物,或
c. 已知是 P-糖蛋白强抑制剂的药物。
15. 怀孕或哺乳的受试者。
研究者信息
1、主要研究者信息
姓名:陆 舜
学位:医学博士
职称:主任医师
单位名称:上海市胸科医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-国家 |
| 1 | 上海市胸科医院 | 陆舜 | 中国 | 上海市-上海市 |
| 2 | 河南省肿瘤医院 | 赵艳秋 | 中国 | 河南省-郑州市 |
| 3 | 北京大学肿瘤医院 | 方健 | 中国 | 北京市-北京市 |



























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城