肿瘤免疫疗法领域在近期可谓是热度飙升。而阿斯利康(AstraZeneca)的首款免疫疗法药物Imfinzi(durvalumab)是一款有望为癌症患者带来希望的免疫疗法药物。作为一种人源化的抗PD-L1蛋白单克隆抗体,它能直接结合PD-L1蛋白,并抑制它与T细胞表面的PD-1蛋白和CD80的结合。肿瘤细胞就无法利用PD-L1/PD-1途径来逃避免疫系统的追杀。Durvalumab也正是利用这一机理,起到激活免疫系统,杀伤肿瘤的效果。先前,它曾获得了美国FDA颁发的与优先审评资格。全球肿瘤医生网整理了德瓦鲁单抗相关的药品信息,供患者参考。
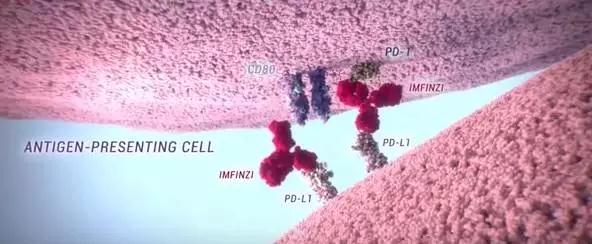
Durvalumab(Imfinzi)
美国药品名称:Imfinzi
FDA批准Durvalumab(2017年5月1日)专门用于:
治疗局部晚期或转移性尿路上皮癌的患者,其:
·1)在含铂化疗期间或之后具有疾病进展
·2)在含铂化疗的新辅助治疗或辅助治疗的12个月内有疾病进展。

Imfinzi作为静脉给药的输液。推荐剂量为10mg / kg,每两周60分钟静脉滴注,直至疾病进展或不可接受的毒性。
临床数据及效果
FDA于2017年5月1日的加速批准是基于一项数据惊艳的编号为1108的研究,那么效果到底如何呢?我们详细看下:
尿路上皮癌I / II期试验1108研究
2017年5月1日,Imfinzi(一种阻断PD-L1的人单克隆抗体)获得FDA加速批准,基于来自研究1108的数据。该I / II期试验评估了Imfinzi在局部晚期或转移性尿路上皮癌患者中的安全性和有效性。在试验中,Imfinzi表现出快速和持久的反应,无论PD-L1状态如何,所有可评估患者的客观缓解率(ORR)分别为17.0%和26.3%,
该队列由182名局部晚期或转移性尿路上皮癌患者组成,其中铂类治疗或铂类治疗后进展,包括在接受新佐剂或佐剂治疗的12个月内进展的患者。这些患者在数据截止日期前至少13周开始了durvalumab治疗。所有患者均通过静脉滴注每2周接受Imfinzi 10 mg / kg长达12个月或直至不可接受的毒性或疾病进展。肿瘤评估在第6,12和16周进行,然后在第一年和第12周每8周进行一次。根据“盲人独立中央评估”(BICR)评估的RECIST v1.1和应答持续时间(DoR),确定了主要疗效结果指标的客观反应率(ORR)。ORR为17%,中位数DoR未达到。在31例患者中,1例(45%)持续6个月以上,6例(16%)持续反应12个月以上。
研究1(关于膀胱癌1108研究的数据)
所有患者
(N = 182)
PD-L1高
(N = 95)
PD-L1低/负(N = 73)
PD-L1无法评估(N = 14)
客观反应率(ORR)
31(17.0%)
25(26.3)
3(4.1%)
3(21.4%)
完全响应(CR)
5
3
1
1
部分响应(PR)
26
22
2
2
中位响应时间(DOR)
还未达到
还未达到
12.3
还未达到
除了尿路上皮癌,德瓦鲁单抗还在哪些癌症中表现突出,值得大家期待呢?
非小细胞肺癌III期PACIFIC试验
阿斯利康2017年7月31日发布的消息,美国食品药品监督管理局(FDA)已授予durvalumab (Imfinzi)用于治疗接受了标准含铂方案的同步放化疗后,未发生疾病进展的无法手术切除的局部晚期非小细胞肺癌(NSCLC)患者突破性疗法称号!此次突破性疗法是基于Imfinzi三期临床试验PACIFIC的中期结果,这是一个双盲,以安慰剂为对照组的多中心研究,研究目的为局部晚期不可手术的非小细胞肺癌患者(III期),在进行以铂类为基础的同步放化疗后,疾病无进展时以Durvalumab作为后续治疗药物的效果。
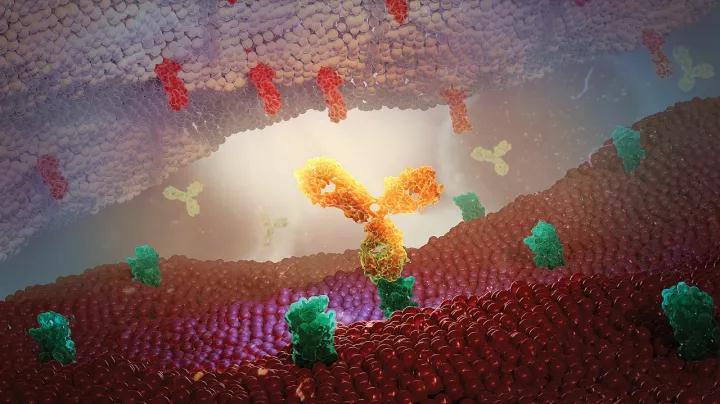
PACIFIC 是一项随机、双盲、安慰剂对照的国际多中心临床研究,Imfinzi (Durvalumab) 作为维持治疗,用于接受了标准的含铂方案同步放化疗后,未发生疾病进展的无法手术切除的局晚期(III期)非小细胞肺癌者。该试验在 26 个国家/地区的 235 个中心进行,入组约 700 多例患者。研究的主要终点为PFS和OS,次要终点包括 PFS 率与 OS率 、客观缓解率 (ORR) 及缓解持续时间等。
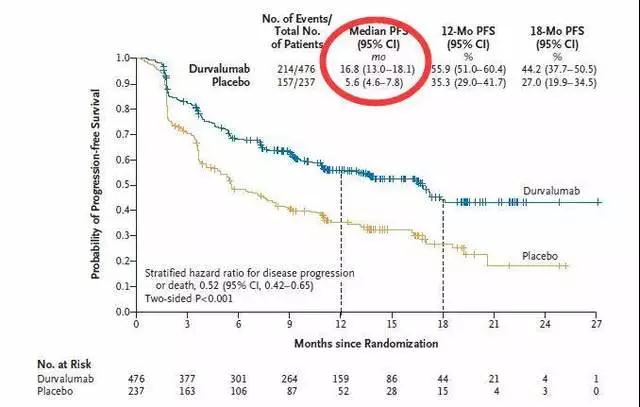
蓝色曲线为接受Durvalumab维持治疗患者的无进展生存期(PFS,即患者生存而肿瘤又没有长大的时间),橙色曲线为接受安慰剂患者。
结果显示:局部晚期患者接受标准的同步放化疗控制肿瘤后再接受Durvalumab维持治疗,肿瘤再次进展的时间达到16.8个月(接近1年半),使用安慰剂的情况只有不到半年(5.6个月)。
关键的是,不管PD-L1表达状态,EGFR是否突变,鳞癌还是腺癌,同步放化疗后肿瘤是缩小还是稳定,是否吸烟Durvalumab的疗效都比安慰剂好。
同时,durvalumab用于非小细胞肺癌辅助治疗的ADJUVANT三期临床试验正在进行中。在IV期的非小细胞肺癌患者的一线治疗中,durvalumab作为单药和与抗CTLA4药物tremelimumab联用的三期临床试验MYSTIC, NEPTUNE 和PEARL也正在进行中。POSEIDON是用于评估durvalumab单药联合化疗、durvalumab与tremelimumab联合化疗对比化疗的三期临床试验。让我们期待更多的临床数据尽快公布。
相关临床试验:01
Durvalumab + / Tremelimumab联合铂类化疗治疗未经治疗的广泛期小细胞肺癌( NCT03043872 )
这是一项III期随机,开放标签,多中心的全球性研究,旨在确定durvalumab±tremelimumab联合铂类化疗(EP),durvalumab±tremelimumab维持治疗与单用EP单药治疗的有效性和安全性。广泛期小细胞肺癌患者。
试验地点:
纽约
哥伦比亚大学/赫伯特·欧文癌症中心
俄亥俄州
克利夫兰综合癌症中心

立即申请
想参加本临床试验的患者可关注全球肿瘤医生网微信公众号,根据提示提交病历资料,医学部会初步评估是否适合,并尽快与您联系,也可登录咨询详情。
Durvalmab作为治疗IIIB-IV期非小细胞肺癌患者的一线治疗( NCT02879617 )
该II期临床试验研究durvalumab的安全性以及作为一线治疗IIIB-IV期非小细胞肺癌患者的效果。durvalumab等药物的设计与免疫系统协同工作,有助于抗癌细胞抵抗肿瘤细胞发送的信号,阻止免疫系统良好运作。本研究中使用的durvalumab可以阻断这种信号,增加免疫反应,可以帮助人体建立有效的免疫应答来杀死肺癌细胞。
实验地点:
宾夕法尼亚
匹兹堡大学癌症研究所(UPCI)

立即申请
想参加本临床试验的患者可关注全球肿瘤医生网微信公众号,根据提示提交病历资料,医学部会初步评估是否适合,并尽快与您联系,也可登录咨询详情。
参考信息:
https://www.astrazeneca.com/media-centre/press-releases/2017/astrazenecas-imfinzi-durvalumab-receives-us-fda-accelerated-approval-for-previously-treated-patients-with-advanced-bladder-cancer-01052017.html
https://www.cancer.gov/news-events/cancer-currents-blog/2017/approvals-fda-checkpoint-bladder?cid=eb_govdel
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm555930.htm
https://www.astrazeneca.com/media-centre/press-releases/2015/Durvalumab-ATLANTIC-trial-supports-clinical-activity-and-AstraZenecas-overall-immuno-oncology-strategy.html
本文由全球肿瘤医生网整理,转载请在文首注明来源。更多药品信息请登录或登录全球肿瘤医生网。
声明:
本公众号内容仅作交流参考,不作为诊断及医疗依据,仅依照本文而做出的行为造成的一切后果,由行为人自行承担责任。专业医学问题请咨询专业人士或专业医疗机构。 







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城