2023年CAR-T细胞疗法重大突破盘点
2023年12月,美国血液学会(ASH)第65届年会圆满结束,作为全球血液学领域的权威盛会之一,本次公布了多项CAR-T疗法的最新临床研究成果。
嵌合抗原受体-T(CAR-T)细胞疗法,自2017年获美国食品和药物管理局(FDA)批准以来,在白血病、多发性骨髓瘤、弥漫大B细胞淋巴瘤等多种恶性血液肿瘤领域,取得了突破性的进展,先后有多款产品获批上市。2023年更是迎来了井喷式的发展,不仅有新药问世,更是突破三线治疗的“天花板”,为更多恶性肿瘤患者带来“长生存”希望!
2023ASH数据盘点,新疗法带来新希望
01、AT101
>>更靠近CD19靶点,较高剂量水平CR可达100%<<
AT101是一种新型CAR-T细胞疗法,通过一种新型抗体,可以靶向更靠近细胞膜的CD19,具有快速的结合和解离速率,可获得更高的功效和非重叠的耐药机制,适用于多种非霍奇金淋巴瘤(NHL),尤其是弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)。在第65届ASH年会上,公布了“AT101治疗复发或难治性B细胞非霍奇金淋巴瘤”的I期临床试验结果。
该研究选取了12例复发或难治性B细胞非霍奇金淋巴瘤(NHL)患者(其中7例DLBCL、3例FL、1例套细胞淋巴瘤)入组,中位年龄为62.5(39-84)岁,这些患者至少一种标准疗法复发或难治,ECOG表现状态为0-1(其中3例ECOG评分为0,9例评分为1)。在淋巴细胞清除后,接受了三次递增剂量的AT101。
结果显示,在对治疗有反应的10例患者中,客观缓解率(ORR)为91.7%(95% CI,56.2–97.0)。
治疗第1个月时,ORR为83.3%(95%CI,51.6-97.9),8例患者观察到CR(66.7%)。
在治疗第3个月时,11例仍存活的患者中,8例有反应的患者均达到CR(72.7%)(95%CI,43.6-92.1)。
图1 AT101治疗前后PET/CT对比
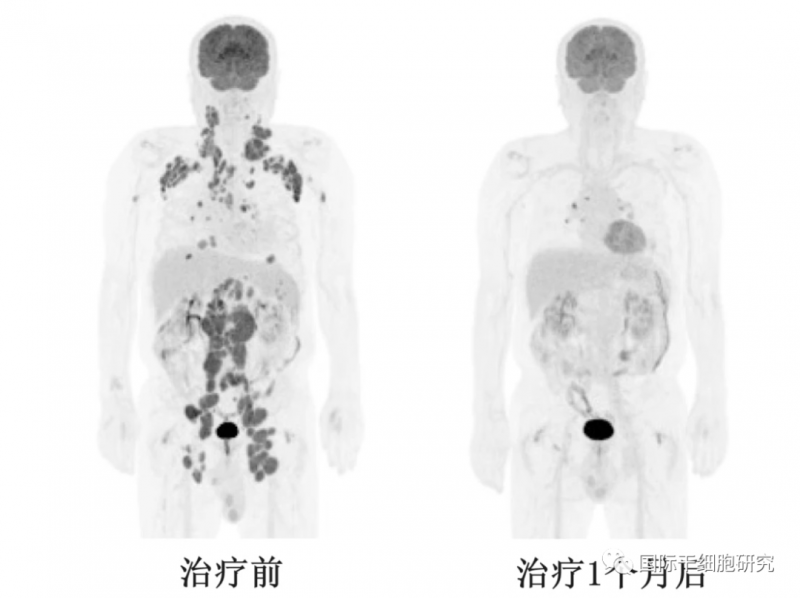
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:10号患者在接受AT101治疗前、治疗1个月后的PET/CT图像,显示出完全的代谢反应。
值得注意的是,在接受活性剂量AT101(DL-2和DL-3)的患者(n=6)中,CR为100%。中位随访时间为9.3个月(1.5-16.5个月),无进展生存期(PFS)达75.0%,总生存率(OS)为82.5%。总之,在本次临床试验中,AT101的早期反应惊艳!
图2 使用AT101治疗后患者的生存期
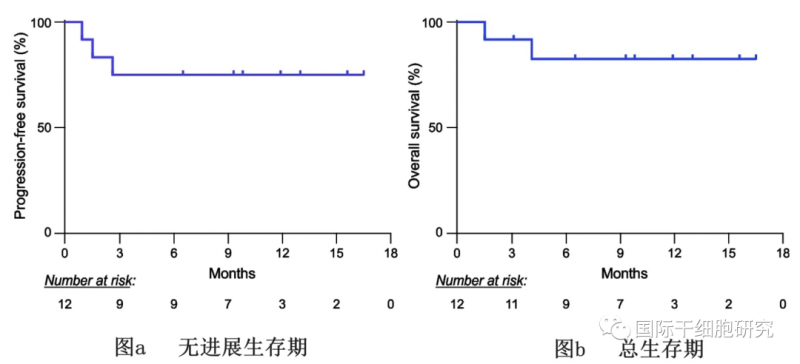
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
正在进行CAR-T临床实验的癌症类型:
●Claudin18.2:用于胃癌,胰腺癌等;
●间皮素(mesothelin):用于治疗间皮瘤、胰腺癌、卵巢癌、肺癌;
●CEA:用于治疗肺癌、结肠癌、胃癌、乳腺癌和胰腺癌;
●MUC-1:用于治疗肝癌、肺癌、胰腺癌、结肠癌、胃癌;
●GPEGFRvII:用于治疗神经胶质瘤、头颈部肿瘤;
●C3:用于治疗肝癌;
●GUCY2C:用于结直肠癌;
●PSMA:用于前列腺癌等;
●B7-H3:用于治疗尤文肉瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、髓母细胞瘤、特别难以治疗的脑干肿瘤(DIPG)。
如上述癌症患者想检测相关靶点或了解详情,可致电医学部,进行初步评估。
02、GLPG5201
>>“新鲜”的CAR-T细胞,ORR达93%<<

▲截图源自“Galápagos”
GLPG5201是第二代抗CD19/4-1BB CAR-T细胞候选产品,用于治疗复发/难治性慢性淋巴细胞白血病(rrCLL)、非霍奇金淋巴瘤(rrNHL),本次ASH大会上也公布了该产品的1/2期临床数据”。
该研究选择15例CD19阳性的rrCLL或rrSLL患者入组,这些患者既往均接受过2线以上治疗,入组后静脉输注GLPG5201。
治疗后,在14例可评估疗效的患者中,客观缓解率(ORR)为93%,完全缓解率(CRR)为57%。截至数据分析时,10例患者(77%)处于持续缓解状态,中位随访时间为6个月。在接受较高剂量(DL2)治疗的8例患者中,ORR为100%,CRR为63%。
这些数据表明,使用新鲜CAR-T细胞的GLPG5201是可行的,有望缩短CAR-T的制备时间,小编也期待该产品能早日获批,以满足无法等待治疗患者的迫切需求。
热门CAR-T疗法回顾与展望
2017年8月30日,FDA批准了由诺华制药公司生产的Kymriah(tisagenlecleucel),用于治疗儿童和青少年急性淋巴细胞白血病。随后又有多款产品相继获批,截至2023年底,获批的CAR-T产品共计10款,其中,国外已上市6款,我国已上市4款,包括2023年11月,刚刚获批用于治疗B细胞急性淋巴细胞白血病的纳基奥仑赛注射液。全球肿瘤医生网小编,汇总了目前已获批上市的CAR-T细胞产品,详见下表:
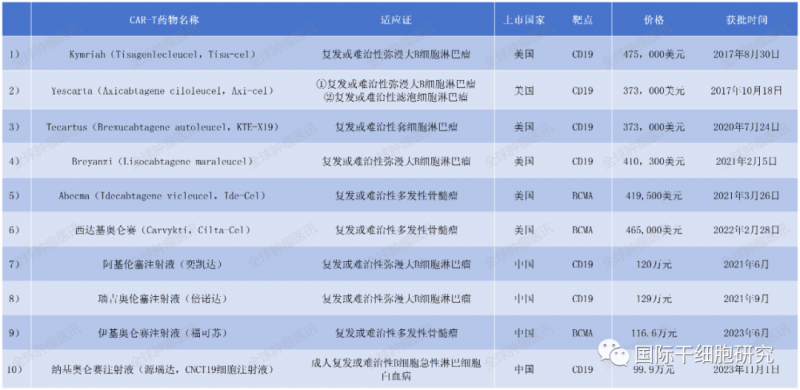
01、Axi-Cel
>>完成首个通过二线治疗,提高侵袭性淋巴瘤总体生存率的3期试验<<
2023年ASCO年会上,提出了Axi-Cel(axicabtageneciloleucel)治疗复发或难治性大B细胞淋巴瘤(LBCL)的3期ZUMA-7试验结果。
本次试验共纳入359例复发或难治性LBCL患者,既往接受一线治疗的时间不超过12个月,将这些患者随机分配到两组,即Axi-Cel组(n=180)、标准治疗组(n=179)。在Axi-Cel组中,172例患者额外接受了淋巴清除;在标准治疗组中,168例患者接受了化学免疫治疗,64例患者接受了HDT-ASCT。
经过为期47.2个月的中位随访,结果显示,Axi-cel组的4年总生存期(OS)率为54.6%,中位PFS为14.7个月;而标准治疗组OS为46.0%,无进展生存期(PFS)为3.7个月(HR,0.506;95%CI,0.383-0.669)。4年PFS率41.8%(Axi-cel组) vs 24.4%(标准治疗组)。
这些数据显示,Axi-Cel不仅延长了患者的生存时间,而且改善了无进展生存期,可作为复发或难治性LBCL患者的二线治疗方式。这也是近30年来首个通过二线治疗,提高侵袭性淋巴瘤患者总体生存率的随机3期试验。
02、Cilta-Cel
>>可在多发性骨髓瘤治疗早期使用,总体缓解率高达84.6%<<
在3期CARTITUDE-4试验(NCT04181827)中,纳入了419例多发性骨髓瘤(MM)患者,他们既往接受过蛋白酶体抑制剂和免疫调节剂治疗,并将其随机分到Cilta-Cel组、标准治疗组。
结果显示,Cilta-cel组的总体缓解率为84.6%,标准治疗组的总体缓解率为67.3%(95% CI,1.8-5.0)。12个月的PFS率分别为76%(Cilta-cel组) vs 49%(标准治疗组)。
这些数据表明,与标准治疗相比,对于先前接受过1至3线治疗的MM患者,Cilta-cel显著改善了PFS,Cilta-cel可以在MM治疗早期使用。
国内多家癌症中心启动CAR-T细胞疗法临床实验,下一步直指实体瘤
在细胞疗法出现之前,包括晚期肝癌、胰腺癌、结直肠癌等实体瘤,通常采取手术、放化疗等方式进行治疗,但大多患者术后存在局部复发或转移的风险。近年随着CAR-T细胞疗法研究的不断深入,CAR-T在增殖、代数更迭、细胞因子释放等方面有了明显改进,多款临床试验已将CAR-T细胞用于实体瘤的治疗,并有患者幸运的获得完全缓解!
01、CT011
>>1例肝癌患者获得完全缓解<<
科济药业自主研发的靶向GPC3的CAR-T细胞候选产品——CT011,用于治疗晚期肝细胞癌。
报道显示,1例晚期肝细胞癌患者,在接受CT011与索拉非尼联合治疗后,获得了完全缓解(CR)以及长期生存。
02、GCC19CART
>>结直肠癌客观缓解率达50%<<
上海斯丹赛生物开发的CAR-T产品——GCC19CART,获美国食品和药物管理局(FDA)授予的快速通道资格。
根据实体肿瘤疗效评价标准,1级剂量组(13例患者)客观缓解率(ORR)达15.4%(2/13),2级剂量组(8例患者)客观缓解率达50%(4/8)。
国际前沿T疗法的临床试验正在进行时:
目前正急招急性淋巴细胞白血病、T细胞白血病(T-ALL)、T细胞淋巴瘤、B细胞淋巴瘤、非霍奇金淋巴瘤、胰腺癌、肝癌、结直肠癌、卵巢癌、间皮瘤等多类癌种!申请流程:
●按要求将病历资料提交至医学部;
●医学部初步评估后匹配合适的临床试验;
●向相应的试验中心提交病历资料;
●评估通过后协助患者参加临床试验。
小编有话说
随着阿基仑赛、纳基奥仑赛等多款CAR-T细胞疗法相继获批上市,CAR-T研发领域呈现井喷式的发展态势,科研人员也在不断探索新的靶点、甚至开发双靶点,尝试用于各类血液肿瘤、实体瘤的治疗。据小编获悉,目前国内共有24家企业布局CAR-T疗法,除复星凯特外,还有药明巨诺、传奇生物、驯鹿医疗、科济生物、信达生物、西比曼生物等。期望在各国专家的共同努力下,CAR-T细胞可以突破价格和实体瘤的瓶颈,让更多的晚期癌症患者获益!
参考资料
[1]Zhang,Y,et al.Safety and efficacy of a novel anti-CD19 chimeric antigen receptor T cell product targeting a membrane-proximal domain of CD19 with fast on- and off-rates against non-Hodgkin lymphoma: a first-in-human study. Mol Cancer , 200 (2023).
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01886-9
[2]Mitra A,et al. From bench to bedside: the history and progress of CAR T cell therapy[J]. Frontiers in Immunology, 2023, 14: 1188049.
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1188049/full
[3]Giorgioni L,et al.CAR-T State of the Art and Future Challenges, A Regulatory Perspective. Int J Mol Sci. 2023 Jul 22;24(14):11803. doi: 10.3390/ijms241411803.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10380644/
[4]https://healthtree.org/myeloma/community/articles/gprc5d-targeted-car-t-therapies-ash-2023
[5]https://www.clinicaltrialsarena.com/news/cellectis-car-t-cell-therapies-2023/?cf-view
[6]https://lymphomahub.com/medical-information/dual-targeted-car-t-cell-therapy-key-updates-from-tct-2023
[7]https://www.glpg.com/press-releases/galapagos-presents-new-encouraging-data-at-ash-2023-from-ongoing-cd19-car-t-studies-with-glpg5201-and-glpg5101/
[8]https://www.urotoday.com/conference-highlights/asco-2023/asco-2023-prostate-cancer/144897-asco-2023-5019-final-results-from-phase-i-study-of-psca-targeted-chimeric-antigen-receptor-car-t-cells-in-patients-with-linkstatic-castration-resistant-prostate-cancer-mcrpc.html








































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城