双靶向疗法,KRAS抑制剂JDQ443联合SHP2抑制剂TNO155双靶向联合治疗实体瘤疾病控制率66.7%
KRAS是人类最常见的致癌突变之一,尤其是在胰腺导管腺癌(PDAC)、非小细胞肺癌(NSCLC)和结直肠癌(CRC)中。作为靶向治疗中的“钉子户”一般的存在,近40年来,几乎所有靶向药都在KRAS基因突变的面前纷纷折戟。
直到2021年5月28日FDA获批的Lumakras (Sotorasib,AMG510)。这是目前首款获得批准用于KRAS突变的靶向药,也称为科学人员突破KRAS“不可成药”的里程碑!
紧接着,2022年12月12日,美国FDA加速批准了KRAS G12C抑制剂Krazati(adagrasib)上市,用于治疗携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者,这些患者先前至少接受过一种全身性疗法。Krazati(adagrasib)是继sotorasib之后FDA批准上市的第2款KRAS G12C抑制剂。
然而耐药是靶向药不可避免的通病,KRAS G12C靶向药也难逃耐药的“魔咒”。为探究KRAS G12C抑制剂的获得性耐药机制,曾有一项临床研究对17例接受Adagrasib治疗后病情再次进展的KRASG12C突变癌症患者,进行组织学和基因组分析后发现,癌细胞产生耐药的潜在机制主要包括KRASG12C的二次突变或扩增、获得性旁路耐药,以及肺腺癌向鳞状细胞癌的组织学转化。
为了应对KRAS G12C抑制剂耐药机制,采用KRAS G12C抑制剂与其他药物联合使用不失为一个突破性的组合疗法。
疾病控制率66.7%,KRAS抑制剂JDQ443联合SHP2抑制剂TNO155对付实体瘤
就在近日举行过的2023年世界肺癌大会(WCLC)上公布了一项研究显示,针对KRAS G12C突变的实体瘤患者,无论之前是否使用过KRASG12C抑制剂治疗,KRAS G12C抑制剂JDQ443联合SHP2抑制剂TNO155展现出显著的抗肿瘤活性。
JDQ443是一种选择性、共价、口服KRAS G12C抑制剂,其不可逆地将KRAS G12C维持在无活性的GDP结合状态。TNO155是诺华开发的高选择性、变构、口服SHP2抑制剂,同时也是首个进入临床的SHP2抑制剂。
研究人员认为,JDQ443联合TNO155的组合疗法可以改善KRAS G12C实体瘤患者的预后。因为这两种药物联合可以将KRAS变为非活性状态,同时能防止该突变再激活。
此次试验纳入50例患者,其中非小细胞肺癌24例,其他肿瘤患者26例。这些患者的先前治疗线的中位数是3。此外,50%的非小细胞肺癌患者之前接受过KRAS G12C抑制剂治疗,而在所有患者中这一比例为34%。
结果显示:
(1)在既往接受过KRAS G12C抑制剂治疗的12例非小细胞肺癌患者中,33.3%的患者肿瘤完全消失或缩小,其中8.3%的患者肿瘤完全消失,25%的患者肿瘤大幅度缩小,33.3%的患者病情稳定,疾病控制率高达66.7%。
(2)在未接受过KRAS G12C抑制剂治疗的12例非小细胞肺癌患者中,33.3%的患者肿瘤大幅度缩小,50%的患者病情稳定,疾病控制率高达83.3%。
病例分析
在此次数据演示中研究者分享了一名73岁的女性病例。她参加了该试验,患有IV期KRAS G12C突变NSCLC,并且存在PIK3CA、H1047R/TP53和PIK3CA 突变。W53。该患者之前接受过3种治疗,包括14个月的顺铂、培美曲塞和派姆单抗(Keytruda)一线治疗,4个月的sotorasib(Lumakras) 和 2 个月的多西他赛,所有这些治疗均因疾病进展而停药。
值得注意的是,患者在完成 sotorasib治疗4个月后开始接受该研究的治疗。结果发现,该患者的确诊部分缓解率为51.6%,无进展生存期为9个月,在本次调查数据截止时,临床获益持续12个月。
目前无癌家园有多款针对KRAS G12C的靶向药正在招募中
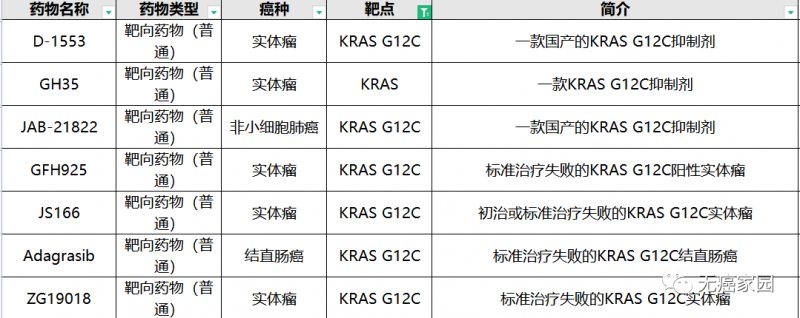
想要评估病情是否符合上述招募条件可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!








































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城