能帮晚期胰腺癌患者疾病控制率达到100%或生存期超过一年的多类胰腺癌治疗方案来了解一下
胰腺癌被临床上视作最难攻破的“癌王”,主要的原因有这么几条:隐匿起病、鉴别困难、进展迅速、容易转移、治疗困难。
这样的特点,导致了大量的胰腺癌患者直到发展至Ⅳ期,才开始接受系统的治疗。但是晚期以及转移性胰腺癌的治疗又非常困难,患者可以选择的方案并不多,接受治疗的过程中也极易发生耐药、进展以及转移。
直到近几年,大量新靶点的药物以及疗法投入临床,才终于改变了这样的困境。这一次,基因药物汇为大家总结了几种近期发展迅速、有较好治疗效果的胰腺癌治疗方案,包括靶向治疗药物、细胞制剂、一些新技术以及患者可以尝试的临床试验,希望能够为胰腺癌患者提供有益的帮助。
靶向治疗:这三个新靶点值得重视
早期,提到胰腺癌的靶向治疗,我们最先想到的是四款药物:厄洛替尼、依维莫司、奥拉帕利和舒尼替尼。这四款药物分别对应着EGFR抑制剂、mTOR抑制剂、BRCA抑制剂以及多靶点受体酪氨酸激酶抑制剂。这四类靶向治疗方案,为晚期胰腺癌的靶向治疗奠定了重要的基础。
而如今,随着靶向治疗研究的发展,已经有多个新靶点的药物,在胰腺癌的治疗中展现出了不错的潜力。
1、KRAS靶点
KRAS是胰腺癌最主要的几个驱动基因突变之一,根据既往的研究,其检出率在10%左右。
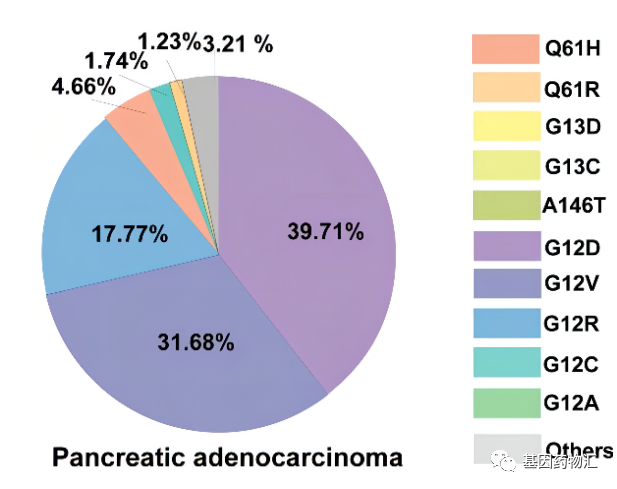
尽管KRAS突变的重要性一直备受关注,但相关药物以及治疗方案的研发进展一直不太理想。自从被确认为原癌突变以后的超过三十年内,KRAS抑制剂的研发都止步不前。并不是没有新药问世,只是各类新药的疗效都不尽理想,很难真正投入临床。
直到2013年,一篇刊登于Nature(《自然》)杂志上的文章,公开了被认为是将KRAS从“不可治”扭转为“可治”的颠覆性研究成果。来自加州大学旧金山分校的研究团队首次发现了KRAS突变蛋白质上能够被小分子药物结合的位点,实现了使用药物使KRAS蛋白质失活的突破。
至2019年,Sotorasib(AMG510)同样在Nature震撼登场,才向所有人证明——KRAS突变的“不可成药”终于成为了历史,KRAS抑制剂的研究终于走上了正轨。
在本年度的ASCO消化道肿瘤分会上,两款经典KRAS抑制剂分别公布了治疗包括胰腺癌在内的多类消化道癌症的最新数据。疗效刷新历史!
阿达格拉西布
根据本年度美国临床肿瘤学会(ASCO)胃肠道肿瘤研讨会上公布的Ⅱ期KRYSTAL-1试验最新数据,Adgrasib(阿达格拉西布,MRTX849)在包括胰腺癌在内的多类消化道肿瘤的治疗当中,都具有非常出色的潜力。
此次Ⅱ期试验涵盖了包括胆道癌、阑尾癌、小肠癌、胃食道结合部癌、食道癌以及胰腺导管腺癌在内的多类消化道肿瘤。目前公开了27例可评估患者的治疗结果,患者均为KRAS G12C突变的患者,先前接受过至少2种系统性抗癌治疗。
结果显示,27例可评估的患者,整体缓解率为41%,疾病控制率高达100%,即全部受试患者均达到了临床疾病稳定。
在10例胰腺癌患者当中,整体缓解率为50%,中位缓解持续时间7.0个月,中位无进展生存期为6.6个月;其它患者的整体缓解率为35%,中位缓解持续时间为7.9个月,中位无进展生存期为7.9个月。
这说明什么?显然,KRAS G12C突变的胰腺癌患者,对于Adgrasib治疗的响应率更高,响应时间也非常不错;其它消化道肿瘤的患者,响应率也不错,响应时间更长。目前这款药物的多项临床试验均在进行当中,其中部分试验正在招募受试患者。希望尝试这款药物或其它同类药物的患者,可以咨询基因药物汇了解详情。
索托拉西布
同样是在本年度ASCO-GI上公布的数据,另一款经典的KRAS G12C抑制剂Sotorasib(索托拉西布,Lumakras,AMG-510)的疗效也非常出色。
根据Ⅰ/Ⅱ期CodeBreaK100试验的数据,使用Sotorasib治疗曾经接受过大量预处理(多线治疗,其中79%的患者接受过至少2种或更多治疗)的KRAS G12C突变的局部晚期或转移性胰腺癌患者,取得了不错的疗效。
患者38例,接受Sotorasib治疗的整体缓解率为21.1%,疾病控制率为84.2%,也就是说有84.2%的患者达到了临床疾病稳定。治疗的中位缓解持续时间为5.7个月,中位无进展生存期为4.0个月,中位总生存期为6.9个月。
Sotorasib对于一部分存在多发转移的患者,同样有非常好的疗效。举例来说,一位64岁的女性患者,基线时存在肝脏、淋巴结、肺以及腹膜多个部位的转移,之前曾经接受过FOLFIRINOX方案的治疗。在接受Sotorasib治疗之前,她的肝脏上有一个直径2.2厘米的病灶;治疗18周后,病灶缩小到了0.8厘米。
2、NTRK靶点
NTRK本身是一种检出率比较低的突变,在胰腺癌当中有检出,但是比例仅占5%以下。但由于几款疗效非常出众的NTRK抑制剂的存在,这部分患者已经有机会得到非常好的治疗了。如果大家检测到了NTRK基因相关的突变,或有意向了解关于这些项目的信息,可以咨询基因药物汇。
拉罗替尼
拉罗替尼(Larotrectinib)是一款NTRK抑制剂,目前已经获批了实体瘤的适应症。在拉罗替尼取得了75%的超高缓解率的实体瘤临床试验当中,就有一部分胰腺癌的患者接受了治疗。
在这些获益的患者当中,相当一部分是已经接受过多种治疗、多次耐药、生存期非常不乐观的患者。凭借拉罗替尼的治疗,许多患者延长了很久的生命,生活质量也有保障!
这位患者的癌症类型比较罕见,属于胰腺腺泡细胞癌,是一种罕见的胰腺外分泌恶性肿瘤。
患者确诊时已是81岁高龄,伴有胰周淋巴结肿大,不过患者状态不错,接受了手术切除,但在术后一个周期的吉西他滨辅助治疗之后,因为耐受性比较差而停止了治疗。
6个月后,患者疾病再次进展,这一次仍然选择了吉西他滨治疗,但降低了剂量。患者的胰周淋巴结大小持续增加,6个周期的治疗后,方案更换为吉西他滨+白蛋白紫杉醇(Nab-紫杉醇)。
联合方案使用仅4个周期之后,患者疾病持续进展,并且发生了新的肝转移。此时的基因检测结果显示患者存在SEL1L-NTRK1融合突变,因此患者开始使用拉罗替尼。
和前一案例当中的患者一样,这位患者使用的方案为标准的100 mg剂量每日两次方案。至案例发布时,患者已经接受了13个月的治疗,影像学缓解效果良好,没有出现严重的不良反应。
3、Claudin 18.2靶点
Claudin 18.2属于紧密连接蛋白家族中的一种亚型,在多种肿瘤组织中高度表达,比如胃癌(60%~80%)、胰腺癌(50%)、食管癌(30%~50%)和肺癌(40%~60%)等,但是在正常组织中几乎没有表达,因而具有出色的治疗潜力。
根据一些报告,大约28%的胰腺癌患者,表达Claudin 18.2的癌细胞能够超过75%。
其中,Claudin 18.2抑制剂Zolbetuximab已经到达了Ⅱ期临床试验阶段,多款同靶点其它药物也有一定的成果。如果胰腺癌患者希望尝试这一靶点的治疗方案,或者了解相同靶点的其它药物,可以联系基因药物汇。
细胞疗法:两个新靶点开启胰腺癌细胞治疗新时代
首先必须肯定的是,细胞疗法的发展,和靶点的研究是密不可分的。就在近两年,依托于间皮素(MSLN)和Claudin 18.2这两个靶点的免疫细胞治疗方案,为胰腺癌的治疗带来了新的希望。
1、间皮素(MSLN)靶点
间皮素又称MSLN,这是一个近期在CAR-T以及CAR-NK疗法当中比较热门的靶点。
正常情况下,MSLN在间皮细胞当中表达,其功能与细胞粘附有一定的关联。MSLN在多类人类肿瘤当中过表达,常见的包括间皮瘤(85%~90%)、胰腺癌(80%~85%)、卵巢癌(60%~65%)、肺癌(60%~65%)、胆管癌(60%~65%)、胃癌(50%~55%)、结肠癌(40%~45%)、胸腺癌(40%~45%)、食管癌(35%~40%)、乳腺癌(25%~30%)以及子宫内膜癌(20%~25%)等。
这样的特点,让MSLN自发现以来就成为了细胞免疫治疗研究的焦点。它就像是一个颇具潜力的“靶子”,能够指导经过修饰的免疫细胞从众多的细胞当中发现并“瞄准”癌细胞,并且避开正常的细胞。
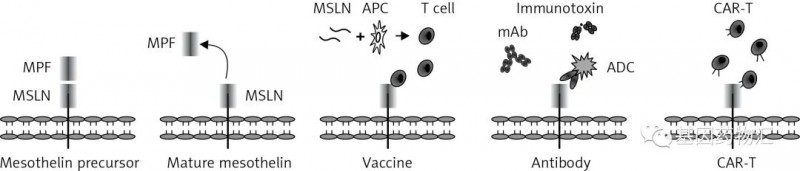
MSLN:间皮素;APC:抗原呈递细胞;ADC:抗体-药物偶联物;mAb:单克隆抗体:CAR-T:嵌合抗原受体T细胞
至于靶向MSLN的CAR-T细胞疗法,在研的临床试验项目更多,其中部分已经公开了数据,覆盖的癌种同样丰富。
有胰腺导管腺癌患者通过CAR-MSLN-T疗法达到部分缓解,及胰腺癌患者通过CAR-MSLN-T疗法达到疾病稳定;恶性胸膜间皮瘤患者中,多例通过CAR-MSLN-T疗法显著地延长了无进展生存期达3.8~5.4个月。此外,卵巢癌等比较多发的癌种当中,同样有患者显著获益。
目前,靶向MSLN的CAR-T及CAR-NK疗法临床试验正在招募患者,部分癌种患者有望入组。希望尝试这类新方案的患者,可以联系基因药物汇-临床新药招募中心了解详情,提交病例进行入组筛选。
2、Claudin 18.2靶点
Claudin 18.2同样是CAR-T细胞疗法一个非常重要的靶点。与MSLN相似,这同样是一个正常组织低表达或不表达、癌症组织有较大概率表达或高表达的靶点。Claudin 18.2尤其常见于胃癌、胰腺癌等,目前也同样已经成为了CAR-T细胞疗法以及一部分靶向药物的关键性靶标。
针对Claudin 18.2的多款药物及CAR-T方案都在招募患者,如果大家没有那些获批方案比较多的突变,却也非常迫切地想要尝试临床试验,那么不妨把这两项都试着测一测。
胃癌、胰腺癌等患者可以优先考虑Claudin 18.2,间皮瘤、卵巢癌、胆管癌以及胰腺癌、肺癌、胃癌、结直肠癌患者可以考虑间皮素。如果还想进一步了解相关的治疗方案和临床试验,或者希望了解相关检测措施,也可以直接咨询医学部。
CT041
CT041是一款由我国自主研发的CAR-T细胞制剂,也是目前进展最快、成果最多的实体瘤CAR-T项目之一。
2021年ESMO大会更新的疗效数据非常出色:接受CT041治疗的患者,共37例,其中胃及胃食管结合部癌患者28例,胰腺癌患者5例,其它癌种患者4例。
所有患者的整体缓解率达48.6%,疾病控制率达73%;所有胃癌患者整体缓解率为57.1%。对于既往接受至少2线治疗失败的胃癌患者,整体缓解率为61.1%,疾病控制率为83.3%。
电场疗法:正在崛起的抗癌"黑科技"
肿瘤电场疗法,简称电场疗法(Tumor-Treating Fields,TTF),这是一种新的癌症治疗模式,通过在病灶区域输出低强度、中等频率、交变的电场,干扰癌细胞的分裂过程,使癌细胞死亡,达到抗癌的目的,属于一种物理的抗癌手段。
简单来说,电场疗法就是通过一些体外的设备,在我们希望处理的病灶部位创造一个电场,然后通过这个电场,影响癌细胞的分裂过程,让它在某个特定的过程当中停滞、最终死亡的治疗手段。
在癌细胞有丝分裂的过程当中,有一个步骤,细胞内会产生一类名为纺锤体和纺锤丝的结构。此时,细胞的遗传物质已经复制成为了两倍,纺锤体会移向细胞的两端,并通过纺锤丝,牵着这些遗传物质均分成为两份移向细胞两端,以备后续细胞分裂成为两个细胞。
而电场作用的时间正是此时。纺锤丝是有电极性的,一端带正电、一端带负电,正常情况下将在细胞内环境的影响下朝向正确的方向。但在外界电场的作用下,纺锤丝进入了另一个完全不符合分裂期要求的环境里,被迫不断地随着电场掉转方向,无法维持正常结构,最终崩散。而染色体无法正常分离的时候,癌细胞也会走向死亡。

(图片来源:维基百科)
图为细胞有丝分裂过程示意图。绿色方框标记的位置,即电场疗法主要发挥效果的时间段
针对电场疗法治疗胰腺癌的研究很多,并且类型多样、囊括了不同的阶段,例如电场联合体外放疗等等,都有不错的潜力。
其中,PANOVA试验纳入了40例晚期胰腺癌患者,20例接受电场疗法+吉西他滨治疗,20例接受电场疗法+吉西他滨+白蛋白紫杉醇治疗。
电场疗法+吉西他滨治疗的患者,中位无进展生存期为8.3个月,中位总生存期为14.9个月;既往研究当中,仅使用吉西他滨治疗,患者的中位无进展生存期仅有3.7个月,中位总生存期仅6.7个月。
电场疗法的加入,让患者的生存期翻倍!
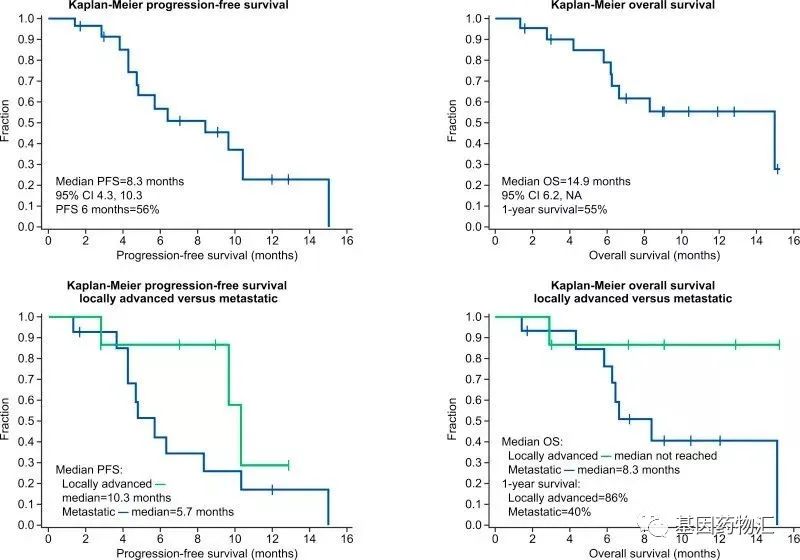
电场疗法+吉西他滨+白蛋白紫杉醇治疗的患者,中位无进展生存期为12.7个月,既往研究中白蛋白紫杉醇+吉西他滨治疗的患者仅有5.5个月;1年生存率同样翻倍,达到72%,既往研究中仅有35%!
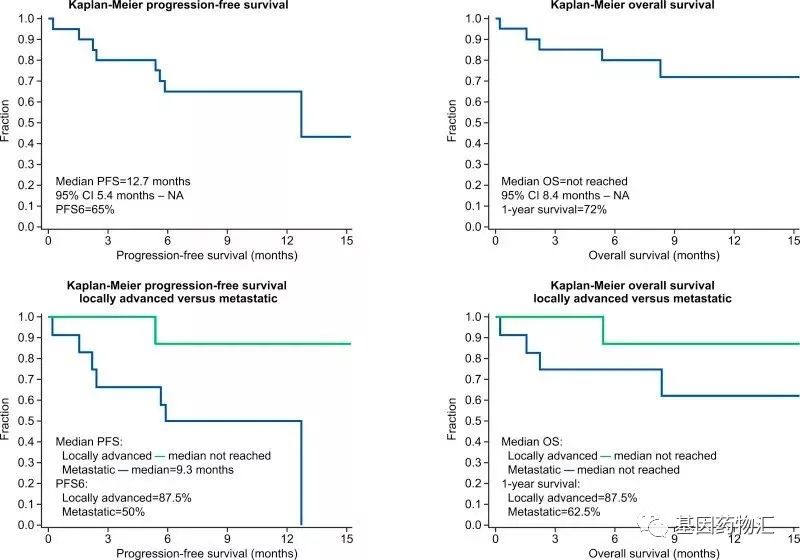
目前电场疗法治疗胰腺癌的临床试验已经在推动了,大家可以咨询基因药物汇了解详情。
电场疗法最大的优势其实在于它的副作用方面,受试患者仅出现了一些皮肤方面的副作用(21例),基本来自于长期贴敷设备导致的皮炎,并没有额外的损伤。








































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城